美國FDA Sentinel共同資料模型以及其應用簡介
講者 : 王繼娟副教授 國立台灣大學 藥學系
關鍵字: FDA、SCDM、TSDM
文 / GHD團隊 / 李修安、劉貞沂
王繼娟博士的演講針對美國食品藥物管理局(U.S. Food and Drug Administration, FDA)Sentinel共同資料模型(Sentinel Common Data Model, SCDM)的發展、結構及其應用進行分享,詳述Sentinel計畫的背景、SCDM的結構、主要應用案例以及其對醫療產品上市後安全監測和實證醫學的貢獻。
圖一: 王繼娟博士演講剪影
Sentinel計畫由FDA於2008年啟動,其主要目標是監測已核准的醫療產品在臨床市場上的安全性,並建立一個分散式數據網路來進行上市後安全分析。透過Sentinel計畫,FDA可以迅速檢測出潛在的安全信號,並採取必要的措施以確保公眾健康。
Sentinel計畫的運作由三個主要中心負責:
• 運作中心:管理合作夥伴關係,支援上市後安全性分析,並開發新型分散式分析工具。
• 創新中心:專注於開發新的分析方法,利用電子健康記錄(electronic health record, EHR)等新數據來源以加強實證醫學的能力。
• 社區建設與外展中心:負責與相關利益個人或組織的溝通與協作,提升公眾對Sentinel工具的認識與使用。
SCDM是一種標準化數據模型,目的為統一不同數據來源的資訊格式與編碼,進而確保數據分析的一致性和可比較性,SCDM的標準化過程有助於提高數據的品質,確保來自不同醫療機構和地區的數據可以在統一的框架下進行比較和分析。SCDM的編碼系統涵蓋了診斷、處方、處置和疫苗接種等多種資料:
• 診斷編碼:使用ICD-9、ICD-10和SNOMED CT等標準。
• 處方和藥品編碼:採用美國國家藥品代碼(National Drug Code, NDC)、SNOMED CT、RxNorm等標準。
• 處置和疫苗編碼:包括ICD-11、CPT、CVX等標準。
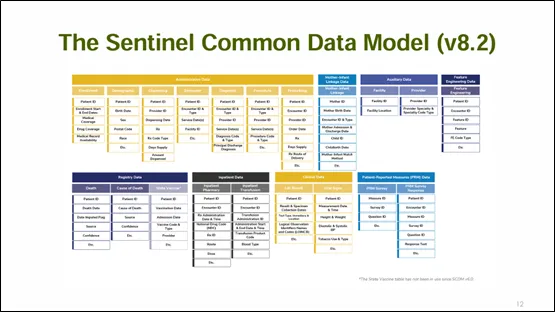
圖二: SCDM架構
SCDM的分散式數據網路讓數據所有者保留數據的所有權,同時透過去識別化處理和網路安全環境,確保患者隱私的保護。該網路符合美國《健康保險可攜性與責任法案》(Health Insurance Portability and Accountability Act, HIPAA)和聯邦資訊安全管理法案(Federal Information Security Management Act, FISMA)的要求。
Sentinel系統的主要應用
上市後安全分析
Sentinel系統的主要應用之一是進行上市後安全分析。它透過三個層次的分析工具來進行:
• 訊息識別(Level 1):進行描述性分析,以檢測出潛在的安全訊息。
• 回溯推論分析(Level 2):深入分析以評估已發現的訊息之可信度。
• 前瞻性順序推論分析(Level 3):進行預測性分析,以評估未來風險。
監管通訊和標籤變更
Sentinel系統的分析結果可用於支援FDA的安全通訊和產品標籤的更新。例如,針對藥品的副作用分析可能導致藥品標籤的變更或警示訊息的增加。
全球合作
Sentinel系統不僅限於美國國內的應用,它還與英國、加拿大和丹麥等國合作,共享數據和技術資源。這種全球合作有助於加強跨國界的醫療產品之安全監測。
台灣參考Sentinel的數據模型,建立了台灣Sentinel數據模型(Taiwan Sentinel Data Model, TSDM),用於進行國內的藥品安全監測和實證醫學研究。TSDM導入了Sentinel系統的常規查詢工具,並在三百萬人樣本的基礎上進行數據分析。在TSDM的應用中,研究者針對幾個常見藥物的安全性進行了深入分析,例如:
• ACE抑制劑與血管性水腫的關聯。
• 華法林與胃腸道出血的風險。
• 口服克林達黴素與艱難梭狀芽孢桿菌感染的相關性。
• 格列本脲與嚴重低血糖的風險。
這些分析結果對台灣的藥品監管和臨床使用提供了重要參考。
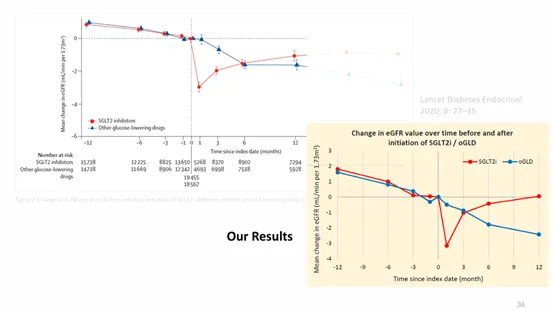
圖三: 台灣研究數據與國外研究數據比較示例
Sentinel系統的價值與挑戰
• 提高數據一致性和分析準確性
Sentinel系統的標準化數據模型有助於提高數據的一致性,可以將不同來源的數據進行可比性分析,此數據的一致性對於評估藥品的長期安全性和有效性相當重要。
• 強化實證醫學的應用
Sentinel系統利用真實世界數據(Real-world Data, RWD)進行分析,從而為臨床決策提供了真實世界證據(Real-world Evidence, RWE)實證基礎,透過對大量患者數據的分析,Sentinel系統能夠更準確地評估醫療產品在不同人群中的效果和風險。
• 挑戰與未來發展
儘管Sentinel系統在安全監測和實證醫學領域取得了顯著成效,但在應對數據異質性、數據安全和隱私保護等方面仍面臨挑戰。未來,Sentinel系統將加強與其他國際數據標準的整合,如HL7® FHIR®,以進一步提升數據互通性和跨國合作。
Sentinel共同資料模型及其應用在提升美國及其他國家的藥品安全監測和實證醫學研究方面發揮了重要作用。SCDM透過標準化資料和分散式數據網路的建置,確保了數據的一致性和可比性,並為全球的醫療產品監管和實證醫學發展提供了厚實的基礎。隨著台灣和其他國家進一步推動Sentinel系統的在地化應用,我們期待未來全球的醫療產品監測和數據標準化都能持續強化,確保藥品與醫材的長期安全性,永續的保障患者與醫藥企業的權益。



