講者 : 蕭金福研究員 國家衛生研究院 群體健康科學研究所
關鍵字: CDISC、臨床試驗資料、數據標準
文 / GHD團隊 / 李修安、陳冠文
國家衛生研究院人口健康科學研究所的蕭金福研究員在2024年Taiwan Gateway to Health Data年度會議中,介紹臨床數據交換標準聯盟CDISC(Clinical Data Interchange Standards Consortium)的起源、發展以及在臨床試驗中的應用與價值,並詳述CDISC標準的應用及其在臨床試驗中的實用案例,更進一步探討其對醫療研究和法令合規的貢獻。

圖一: 蕭金福研究員演講剪影
CDISC成立於1997年,最初由一群志願者組成,目的是推動臨床試驗數據的標準化。2000年後,CDISC成為一家非營利組織,並得到製藥、醫療生物技術公司、CRO(合約研究組織)、技術供應商、學術機構及政府機構的支援。
CDISC的主要使命是開發標準化的數據模型,以提高臨床研究的效率,確保臨床數據提報的規範化,這些標準讓臨床數據在不同的研究中具備可比較性和可重複性,同時有助於監管機構在審查數據時一致性的解釋和理解。CDISC標準由一系列的數據模型和數據格式規範組成,涵蓋了從試驗計畫的設計到結果數據提報的整個臨床試驗過程。
圖二: CDISC基礎標準文檔
CDISC的主要標準及其功能:
• 臨床試驗計畫書模型(Protocol Representation Model, PRM)
PRM用於描述試驗計畫書的設計,包括研究設計、受試者資格標準和納入條件要求。此一模型與HL7合作開發並支援試驗計畫的內容和格式標準。
• 操作數據模型(Operational Data Model, ODM)
ODM是基於XML的標準,用於數據的獲取、交換、報告和儲存。它適用於臨床研究中基於個案報告表(CRF)的數據管理,並為數據的結構和格式提供規範。
• 研究數據製表模型(Study Data Tabulation Model, SDTM)
SDTM是用於數據表格製作的標準,涵蓋了臨床研究的各種數據,包括人口統計、介入措施、不良反應事件和實驗室檢查數據等。
• 分析數據模型(Analysis Data Model, ADaM)
ADaM用於分析數據集的製作和提報,主要應用於法規合規的數據提交。ADaM數據集支援數據分析和統計結果的呈現。
• 個案報告表數據定義規範(Define.XML)
Define.XML是基於ODM的拓展,用於描述SDTM數據集的結構和內容,是數據提報時的關鍵文件。
CDISC標準在臨床試驗中的應用
• 臨床試驗資料管理系統(CTIMeS)的使用
CTIMeS是一個基於CDISC標準設計的臨床試驗訊息管理系統,目標為規範數據流和管理流程,並支援各類型臨床試驗的運作,包括研究者發起的試驗和受資助的試驗。
• 符合監管要求的數據
根據美國FDA和日本PMDA的要求,自2016年和2020年起,臨床試驗結果數據的提報必須遵循CDISC標準(包括SDTM、ADaM和Define.XML),這些標準有助於確保試驗數據的透明性和一致性,並加速監管機構的審查流程。
• CDISC的全球應用案例
CDISC標準在美國、日本、歐洲和中國的應用最為普遍,同時在印度、澳洲、韓國等地區的應用也在逐漸增長。這種全球性的採用不僅提升了數據的一致性,還促進了跨國臨床試驗的合作和數據共享。
蕭研究員在演講中指出,採用CDISC可以顯著提高臨床研究的效率,數據模型的標準化使得研究人員可以在不同的試驗中使用統一的數據結構和定義,減少了數據處理和清洗的時間,從而加快了試驗的進展。標準的統一性和嚴謹性則使不同臨床試驗中的數據能夠直接進行比較和整合,提升了數據的可重複性。這對於監管審查、跨試驗分析和Meta分析等方面具有重要的意義。在該標準設計下,不僅在數據提交方面符合監管要求,還能夠支援法規機構在審查數據時的透明性和解釋性。例如,SDTM和ADaM標準的應用使得數據的審查和解釋變得更加直接和易於理解。同時也在推動數據標準的全球合作,CDISC與其他標準組織(如HL7)進行了廣泛合作,推動全球範圍內數據標準的發展。這種合作有助於減少重複工作,提高數據共享的效率,並促進跨領域的數據互通性(interoperability)。
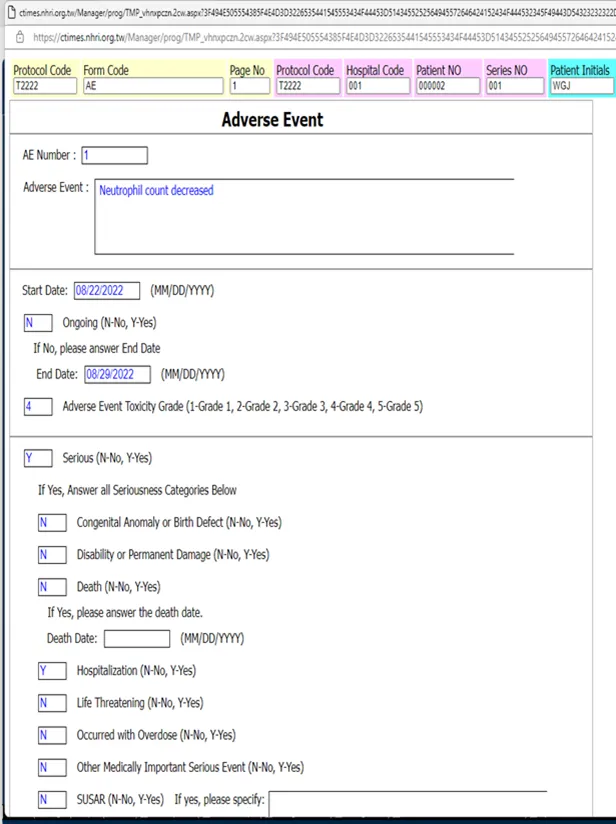
圖三: TCOG統計中心所開發之臨床研究資訊管理系統
CDISC標準的挑戰與未來發展
• 標準的複雜性與實施挑戰
CDISC標準的完整實施需要研究者、CRO和技術供應商之間的協同合作。由於標準結構較為複雜,需要一定的學習和訓練過程,這對於中小型臨床試驗組織而言是一個挑戰。
• 與其他數據標準的整合
CDISC與FHIR和OMOP CDM的整合是未來發展的重點。這種整合將進一步提升數據的互通性,推動智慧醫療和精準醫療的發展。
• 強化標準的全球應用
CDISC未來的發展將致力於進一步推動此標準在新興市場和發展中國家的應用,以確保全球臨床數據的一致性和透明性。
整體演講說明了CDISC標準在臨床試驗數據的管理和申請中扮演了重要的角色,它不僅提升了臨床試驗的效率,還確保了數據的一致性和可比較性,促進了跨國合作和數據的透明化。隨著此標準的進一步發展和與其他國際標準的整合,CDISC將在智慧醫療和精準醫療領域發揮更大的作用。



